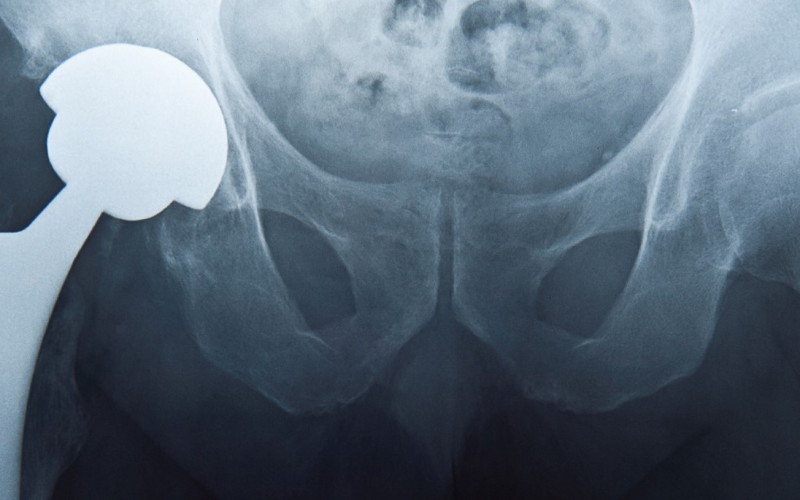
Brytyjska firma wycofała z rynku tysiące endoprotez stawu biodrowego. Wszczepiano je także w Polsce, ale o tym nasi pacjenci nic nie wiedzą Część z tysięcy osób, którym od lipca 2003 r. do sierpnia 2010 r. wymieniono u nas operacyjnie zniszczony staw biodrowy, otrzymała endoprotezę firmy DePuy – jednej z dwóch serii uznanych potem za wadliwe, być może szkodliwe dla zdrowia. Dwie wadliwe serie DePuy International Ltd, brytyjska spółka należąca do holdingu Johnson & Johnson, jest znanym producentem endoprotez stawu biodrowego. W latach 60. jako jedna z pierwszych wprowadzała całościową wymianę tego stawu na sztuczny. Między rokiem 2003 a 2010 wyprodukowała i rozprowadziła w wielu krajach świata ok. 93 tys. protez stawu biodrowego ASR XL Acetabular System oraz ASR Hip Resurfacing System. Zakupiły je także polskie szpitale, a potem wszczepiły pacjentom. Ilu? Żadna instytucja medyczna, do której się zwróciłam, nie przekazała mi takich danych. Wyjaśniano, że poszczególne szpitale sprowadzają endoprotezy indywidualnie. Znam szpitale, gdzie w tym czasie wszczepiono pacjentom kilkadziesiąt tego typu endoprotez, poznałam ortopedę, który założył ich ponad sto, przypuszczam więc, że w Polsce ma je co najmniej tysiąc osób. Być może znacznie więcej. Nie jestem pewna, czy ludzie ci wiedzą, kto je wyprodukował i jakiej są serii, ale metryczka z tymi informacjami powinna się znajdować w ich dokumentacji medycznej. W sierpniu 2010 r. firma DePuy wycofała endoprotezy dwóch wymienionych serii, oferowane na rynku medycznym od lipca 2003 r., i powiadomiła o tym ich odbiorców. Akcentowała, że decyzja o wycofaniu produktów była dobrowolna, ale podjęto ją, gdy okazało się, że endoprotezy te zagrażają zdrowiu osób, którym je wszczepiono – u ok. 12-14% pacjentów trzeba było wadliwą protezę usunąć. Niektóre dane mówią, że w ciągu sześciu lat wadliwość implantu dała o sobie znać u niemal połowy pacjentów. Producent został zmuszony do pokrywania kosztów badań i leczenia tysięcy osób, wypłaca też odszkodowania. List do pacjenta Informując o wadliwości endoprotez, firma dodała: „Wycofanie tych produktów oznacza, że może konieczne będzie monitorowanie pacjentów i wykonanie dodatkowych badań”. Przesłała też do nabywców, a więc także do szpitali polskich, informację medyczną oraz zalecenia zawierające ostrzeżenia Brytyjskiej Agencji Leków i Produktów Leczniczych. Dołączono również już zredagowany „List do pacjenta”, który powinien być wysłany do osób ze wszczepioną wadliwą protezą: „Szanowna Pani/Szanowny Panie (…) Jak wynika z doniesień, niektórzy pacjenci z endoprotezą stawu biodrowego, jaką wszczepiono również u Pani/Pana, mają problemy, które wymagają dodatkowego postępowania i potencjalnie dalszego leczenia. W związku z powyższym firma DePuy Orthopaedics Inc., producent endoprotezy, powiadomiła mnie o wycofaniu produktu ASR TM Hip System i zaleciła przeprowadzenie oceny stanu pacjentów. Proszę o telefoniczne uzgodnienie terminu wizyty w moim gabinecie w celu dokonania oceny stanu Pani/Pana endoprotezy stawu biodrowego. Podczas tej wizyty chciałbym omówić z Panią/Panem ewentualne niepokojące objawy/problemy, wykonać dodatkowe zalecone badania i ustalić najlepszy plan badań i dalszego leczenia. Koszty badań i wizyt kontrolnych pokryje firma DePuy, jak opisano w załączonym dokumencie »Informacje dla pacjentów«. (…). Wszelkie pytania dotyczące działania implantu proszę kierować do mojego gabinetu. Odpowiedzi na pytania dotyczące opłat za leczenie można uzyskać, dzwoniąc do DePuy, pod numer telefonu zamieszczony w dokumencie »Informacje dla pacjenta« (…). W załączeniu do niniejszego listu przesyłam również »Formularz zgody pacjenta«. Wypełnienie tego formularza umożliwi mi udostępnienie informacji związanych z Pani/Pana protezą stawu biodrowego firmie DePuy, a także innym stronom działającym w jej imieniu. Informacje te są niezbędne do ustalenia, czy jeden z wycofanych produktów został wszczepiony w Pani/Pana przypadku oraz czy poniesione koszty leczenia podlegają zwrotowi (…)”. Bez paniki, ale… Z treści przygotowanego przez firmę listu do pacjentów wynika, że podpisać się pod nim powinien ortopeda, który wykonał operację wszczepienia endoprotezy, albo szpital, gdzie ją przeprowadzono. Jednak dzisiaj, po pięciu latach od przesłania tego listu przez DePuy, okazuje się, że liczni polscy pacjenci z endoprotezami uznanymi za wadliwe go nie otrzymali i trudno dociec, czy w ogóle został do kogokolwiek wysłany. Nie wiedzą zatem, że w ich ciele tkwi proteza, która może szkodzić zdrowiu, a jeśli odczuwają jakieś dolegliwości, nie zdają sobie sprawy